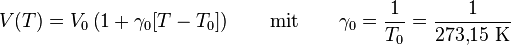Das Gasgesetz von Gay-Lussac
 Joseph Louis Gay-Lussac
Joseph Louis Gay-Lussac
geboren am 6. Dezember 1778 in Saint-Léonard-de-Noblat
gestorben am 9. oder 10. Mai 1850 in Paris (Sein Grab ist auf dem Friedhof Père Lachaise in Paris)
Lebenslauf
Aufgrund seiner mathematischen Fähigkeiten wurde der 18-jährige Gay-Lussac in Paris an die Schule "École Centrale des Travaux" (heute Polytechnikum) aufgenommen, wo er sich bewährte und von dort an die "École des ponts et chausées" gelangte. Hier arbeitete der französische Chemiker Claude Louis Graf von Berthollet (1748-1822), der das Talent des jungen Gay-Lussac erkannte und ihn unterstützte.
Nach dem Studium arbeitete Gay-Lussac für kurze Zeit in einer Bleicherei. Nach der Schliessung des Betriebs wurde er Repetitor am Polytechnikum. Bei dieser Aufgabe arbeitete er mit Studenten zusammen und ging mit ihnen den Lehrstoff durch. An der Hochschule erlangte er im Jahr 1808 den Professorenstatus, er wurde auch als Professor für Physik und Chemie an der Pariser Universität Sorbonne angestellt. Im gleichen Jahr verletzte sich Gay-Lussac bei einem Experiment mit Kalium schwer. Bei der Explosion verlor er einen Teil seines Sehvermögens. Bei einem späteren Unfall - während der Destillation von Ölen - wurde er schwer an der Hand verletzt. Diese Verwundung schränkte ihn erheblich ein. Sie bereitete ihm bis zu seinem Tod im Jahr 1850 viel Schmerzen. Trotz dieser Handicaps konnte sich das Talent des Chemikers entfalten.
Gay-Lussac sprach mehrere ausländische Sprachen wie deutsch, englisch oder italienisch fliessend. Er war über 40 Jahre mit seiner Frau Josephine verheiratet, die ihn in allen Bereichen unterstützte. Gay-Lussac arbeitete mit dem Naturforscher Alexander von Humboldt (1769-1859) und vor allem mit dem Pariser Chemiker Louis-Jacques Thénard (1777-1857) zusammen.
Theorien und Werk
Gedankliche Vorarbeiten für das Gay-Lussac Gesetz gab es bereits von einigen bekannten Wissenschaftlern wie Amontons und Charles.
Schon um 1802 erkannte Gay Lussac die Gesetzmässigkeit bei Gasen, dass das Volumen (V) einer Gasportion bei gleichem Druck (p) der Temperatur (T) in Kelvin proportional ist. Nach dem Gesetz von Gay-Lussac dehnt sich ein Gas aus, wenn der Druck (p) gleich bleibt und sich die Temperatur (T) erhöht.
Dieser Zusammenhang wurde schon früher (1787) von Jacques Alexandre César Charles erkannt. Dieser stellte bereits eine gleichmässige Ausdehnung von Gasen (Sauerstoff, Stickstoff, Wasserstoff) im Bereich zwischen 0–100 °C fest, konnte jedoch den Grad der Ausdehnung bei Temperaturerhöhung noch nicht präzise genug bestimmen.
Der Koeffizient der Volumenzunahme, den Gay-Lussac je Grad Temperaturerhöhung bestimmte, lag bei 1/266 (tatsächlich: 1/273). Nach diesem Gesetz ermittelte A. Crawford die Temperatur, bei der das Volumen eines Gases verschwindet. Diese Berechnungen führten nahe an den absoluten Nullpunkt der Temperatur (-273 °C) heran.
Das Gesetz von Gay Lussac
Das erste Gesetz von Gay-Lussac, auch Gesetz von Charles, besagt, dass das Volumen (V) idealer Gase bei gleichbleibendem Druck (p)und gleichbleibender Stoffmenge direkt proportional zur Temperatur (T) ist. Ein Gas dehnt sich also bei einer Erwärmung aus und zieht sich bei einer Abkühlung zusammen.
Für p = const gilt:

T in °K entspricht °C + 273,15
ergibt auch:

Das eigentliche Gesetz von Gay-Lussac (obiges ist nur der Teil, den man meist als das Gesetz von Charles bezeichnet) lautet: