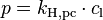Gesetz von Henry
William Henry
 William Henry (* 12. Dezember 1774 in Manchester; † 2. September 1836 in Pendlebury) war ein englischer Mediziner und Chemiker.
William Henry (* 12. Dezember 1774 in Manchester; † 2. September 1836 in Pendlebury) war ein englischer Mediziner und Chemiker.
Lebenslauf
William Henry wurde als Sohn von Thomas Henry (1734–1816), einem Apotheker und Chemiker, geboren. 1795 begann er in Edinburgh Medizin zu studieren und wurde 1807 promoviert.
Wegen seines schlechten Gesundheitszustands gab er seine Tätigkeit als Arzt bald auf und widmete sich vor allem der chemischen Forschung, insbesondere dem Verhalten von Gasen. Eine seiner bekanntesten Veröffentlichungen (Phil. Trans., 1803) beschreibt experimentelle Untersuchungen zur Menge von in Wasser absorbierten Gasen und des Einflusses verschiedener Drücke und Temperaturen auf diese. Seine Ergebnisse sind heute insbesondere in Form des Henry-Gesetzes bekannt. Weitere seiner Veröffentlichungen behandelten die Gas-Analyse, Brandbekämpfung, Leuchtgas, die Synthese von Salzsäure und Ammoniak, Blasen- und Gallensteine sowie die desinfizierende Wirkung von Hitze. Seine Elements of Experimental Chemistry (1799) fanden starken Anklang, und wurden über 30 Jahre in sechs Ausgaben, u. a. in Japanisch, veröffentlicht.
William Henry starb in der Nähe seines Geburtsorts Manchester. Henry entdeckte fast zeitgleich mit John Dalton (1766–1844) das Daltonsche Gesetz über Partialdrücke (deshalb auch oft als Henry-Dalton-Gesetz bezeichnet). Im Jahre 1802 formulierte er das Henry-Gesetz (Henry-Absorptionsgesetz) über die Löslichkeit von Gasen in Flüssigkeiten, wonach die Konzentration eines Gases in einer Flüssigkeit direkt proportional zum Partialdruck des entsprechenden Gases über der Flüssigkeit ist. Diese Proportionalität wird durch die Henry-Konstante ausgedrückt.
Die Erkenntnisse von Henry spielen u.a. eine wichtige Rolle im Bereich der Tauchmedizin und bei der Physiologie der volatilen Anästhetika.
Er identifizierte im Jahre 1808 Methan (CH4) als den entzündbaren Bestandteil von Leuchtgas. Auch zeigte er, dass Ammoniak (NH3) frei von Sauerstoff ist.
Theorien und Werk
Das Henry-Gesetz beschreibt das Löslichkeitsverhalten von (flüchtigen) Substanzen in einer Flüssigkeit. Das Henry-Gesetz besagt, dass der Partialdruck eines Gases über einer Flüssigkeit direkt proportional ist zur Konzentration des Gases in der Flüssigkeit. Die Proportionalität wird ausgedrückt durch die Henry-Konstante  . Die Henry-Konstante ist bei Temperaturänderungen nicht konstant, weswegen sie manchmal auch als Henry-Koeffizient bezeichnet wird.
. Die Henry-Konstante ist bei Temperaturänderungen nicht konstant, weswegen sie manchmal auch als Henry-Koeffizient bezeichnet wird.
Die am häufigsten verwendete Schreibweise ist:
mit
-
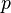 : Partialdruck der Substanz
: Partialdruck der Substanz -
 : Konzentration in der Lösung (Index l für engl. liquid).
: Konzentration in der Lösung (Index l für engl. liquid).
Das Gesetz von Henry beschreibt somit den Sättigungszustand einer Flüssigkeit mit einem darin gelösten Gas.
Bei konstanter Temperatur ist die in einer Flüssigkeit gelöste Gasmenge direkt proportional zum Partialdruck des Gases an der Flüssigkeitsoberfläche, abhängig vom Löslichkeitskoeffizienten des Gases für die jeweilige Flüssigkeit.
Gase haben haben die Eigenschaft, sich in einer Flüssigkeit zu lösen. Gasmoleküle stossen gegen die Oberfläche der Flüssigkeit und dringen zum Teil in sie ein. Das Gasgesetz besagt: Bei doppeltem Druck wird auch die doppelte Gasmenge in der Flüssigkeit gelöst, bei dreifachem Druck die dreifache Gasmenge und so weiter. Dies geschieht jedoch mit einer gewissen Verzögerung.
Das Übertreten nennt man Diffusion. Ist der Teildruck eines Gases über der Flüssigkeit höher, so gehen mehr Moleküle in die Flüssigkeit über. Umgekehrt, höherem Teildruck in der Flüssigkeit treten mehr Gasteilchen aus der Flüssigkeit.
Irgendwann ist die Bilanz ausgeglichen und es gehen genau so viele Teilchen in die Flüssigkeit ein wie auch aus dieser austreten. Kann kein weiteres Gas mehr gelöst werden, spricht man vom Sättigungszustand.
Gase haben haben die Eigenschaft, sich in einer Flüssigkeit zu lösen. Kommt ein Gas mit einer Flüssigkeit wie z.B. mit Wasser und auch mit Blut in Kontakt, so stossen die bewegenden Gasmoleküle gegen die Oberfläche der Flüssigkeit und dringen zum Teil in sie ein. Dieser Vorgang wird weitläufig als passive Diffusion bezeichnet. Befindet sich nun das Gas über der Flüssigkeit so findet ein regelrechter Austausch zwischen den Gasmolekülen im gasgefüllten Raum über der Flüssigkeit und in der Flüssigkeit, bis sich ein Konzentrationsgleichgewicht eingestellt hat. Ist der Partialdruck eines Gases (Gesetz von Dalton) über einer Flüssigkeit grösser als in der Flüssigkeit, so diffundieren mehr Gasmoleküle in die Flüssigkeit als umgekehrt. Das Gasgesetz besagt: Bei doppeltem Druck wird auch die doppelte Gasmenge in der Flüssigkeit gelöst, bei dreifachem Druck die dreifache Gasmenge und so weiter. Dies geschieht jedoch mit einer gewissen Verzögerung. Hat die Flüssigkeit so viel Gasmoleküle aufgenommen, dass der Partialdruck des Gases dem in der Flüssigkeit entspricht, so treten genauso viele Moleküle in die Flüssigkeit ein wie aus ihr heraus. Das nun hergestellte Konzentrationsgleichgewicht befindet sich im sog. Sättigungszustand.
Umgekehrt, bei höherem Teildruck in der Flüssigkeit treten mehr Gasteilchen aus der Flüssigkeit. Aufgrund der Duckverminderung wird nun der Diffusionsvorgang umgekehrt: Einige Gasmolekühle verlassen die Flüssigkeit, d.h. die Gaskonzentration in einer Flüssigkeit kann ebenso den Partialdruck des Gases über der Flüssigkeit bestimmen. In diesem Falle geht das überschüssige Gas vom gelösten in seinen ursprünglich gasförmigen Zustand zurück. Wird die Druckabnahme zu schnell durchgeführt, kann es bei diesem Entsättigungsprozess zur Blasenbildung kommen. Dies ist genau die Ursache für die sog. Dekompressionskrankheit.
Die Menge, die gelöst werden kann, steigt mit
- dem Teildruck
- abnehmender Temperatur
- Löslichkeit des Gases (Fett löst Stickstoff zum Beispiel viel besser als Wasser)
- der Flüssigkeitsmenge
Die Geschwindigkeit, mit der dieser Vorgang von statten geht, ist weiterhin abhängig von
- der Oberfläche
- dem Druckgefälle
Ursache für die Entstehung der Dekompressionskrankheit
Dieses Gasgesetz ist der Grund für die Entstehung der Dekompressionskrankheit.
Unabhängig vom Tauchen befindet sich in unserem Körper immer eine gewisse Menge Inertgas. Diese Menge ist abhängig von dem den Taucher umgebenden Drucks. Taucht man tiefer, löst sich mehr Stickstoff im Blut (wenn man mit Luft taucht), taucht man wieder flacher, wird der Stickstoff wieder abgeatmet. Diese Betrachtungsweise ist etwas vereinfacht, reicht aber zunächst einmal aus um die Grundlagen der Tauchmedizin zu verstehen.
Da die Temperatur vereinfachend als konstant betrachtet wird, kann man sagen dass mit steigendem Druck mehr Gas im Körper gelöst wird und umgekehrt. Während des Aufstiegs wird das gelöste Gas über die Lunge wieder abgeatmet. Taucht ein Taucher jedoch zu schnell auf oder verletzt er die Austauchvorschriften, kommt es zu einem Überschreiten des Löslichkeitsprodukts. D.h. es können sich kleine Inertgasblasen im Gewebe oder im Blut bilden. Diese Gasbläschen sind die Ursache für das Auftreten der Symptome einer Dekompressionserkrankung. Es wurden jedoch schon bei Tauchgängen ab 4m Tiefe venöse Blasen nachgewiesen. Diese Blasen bleiben normalerweise im Lungenfilter stecken und werden dort abgeatmet. Je tiefer und länger ein Tauchgang andauert und mit der Zahl der Wiederholungstauchgänge wird die Zahl der gebildeten Gasbläschen jedoch deutlich mehr. Deshalb tritt die Dekompressionskrankheit meist nach tiefen und längeren Tauchgängen oder nach Wiederholungstauchgängen auf.
Grenzen der Gültigkeit
Strenggenommen ist das Henry Gesetz nur für kleine und mässige Drücke bis ungefähr 5 bar anwendbar. Und es ist nur für verdünnte Lösungen gültig, d.h. bei niedrigen Partialdrücken. Zudem darf das gelöste Teilchen nicht mit dem Lösungsmittel reagieren, wie Kohlenstoffdioxid mit Wasser, da sonst das Gleichgewicht gestört wird.
Temperaturabhängigkeit
Es zeigt sich, dass die Löslichkeit von Gasen in Wasser bei steigender Temperatur abnimmt. Erhitzt man beispielsweise mit Stickstoff gesättigtes Wasser von 25°C auf 95°C, so nimmt die Löslichkeit auf etwa 43% des Anfangswertes ab. Dieses beobachtet man beim Erhitzen von Wasser in einem Kochtopf, kleine Gasblasen bilden sich und steigen auf lange bevor die Flüssigkeit siedet. Taucht ein Taucher in sehr kaltem Wasser, so kühlt er aus und löst mehr Stickstoff in seinem Körper, als es bei warmem Wasser der Fall wäre.
Wenn man die maximale Löslichkeit von Luftstickstoff in Wasser in mmol pro kg angibt, dann lösen sich bei 0°C 1.05mmol, bei 10°C 0.83mmol, bei 20°C 0.68mmol, bei 30°C 0.58mmol, bei 40°C 0.51mmol, bei 50°C 0.44mmol, bei 60°C 0.38mmol, bei 70°C 0.304mmol, bei 80°C 0.236mmol und bei 90°C 0.136mmol. Entsprechende Werte für Sauerstoff sind im Bereich zwischen 0 und 60 °C fast genau doppelt so gross wie diejenigen von Stickstoff.